DICAS QUENTES DE QUIMICA
A grande vantagem da teoria dos ácidos e bases de Brönsted – Lowry está na abordagem do meio em que estão presentes estas substâncias. Enquanto a teoria clássica ficou restrita a meios aquosos, onde ácidos liberam íons hidrogênio e bases liberam hidroxila, esta foi mais além, mostrando que o próton de hidrogênio é o responsável pelo caráter ácido-básico. Tendo em vista que provou ser uma teoria que se adapta a qualquer solvente prótico enquando nesta categoria espécies químicas (substância, molécula ou íon) que até então a teoria clássica foi insuficiente para explicar.

Ainda através desta reação é possível observar a força de um ácido, que nada mais é do que a sua capacidade de conduzir corrente, em função de sua protólise, sendo na verdade os responsável pela condução de corrente, caráter ácido e base somente o próton.

 Os metais são elementos químicos que possuem várias propriedades específicas, como brilho, condutividade térmica e elétrica, maleabilidade e ductibilidade. Todos os metais são sólidos à temperatura de 25ºC e pressão de 1atm, exceto o mercúrio (Hg) que é líquido nestas condições.
Os metais são elementos químicos que possuem várias propriedades específicas, como brilho, condutividade térmica e elétrica, maleabilidade e ductibilidade. Todos os metais são sólidos à temperatura de 25ºC e pressão de 1atm, exceto o mercúrio (Hg) que é líquido nestas condições.

 Os semimetais, em determinadas condições comportam-se como metais, noutras como não-metais. Os semimetais apresentam brilho metálico, tem pouca condutibilidade térmica e fragmentam-se.
Os semimetais, em determinadas condições comportam-se como metais, noutras como não-metais. Os semimetais apresentam brilho metálico, tem pouca condutibilidade térmica e fragmentam-se.
As propriedades periódicas podem ser: raio atômico, volume atômico, densidade absoluta, eletronegatividade, eletropositividade, eletroafinidade.
Esse fato obedece a Lei da Periodicidade de Moseley:
 O raio atômico dos elementos é uma propriedade periódica porque seus valores só variam periodicamente, ou seja, aumentam e diminuem seguidamente, com o aumento do número atômico.
O raio atômico dos elementos é uma propriedade periódica porque seus valores só variam periodicamente, ou seja, aumentam e diminuem seguidamente, com o aumento do número atômico.
O raio atômico (r) é a metade da distância internuclear mínima (d) que dois átomos desse elemento podem apresentar, sem estarem ligados quimicamente.
Para medir o raio atômico, usa-se a técnica da difração por Raios-X.
Esta constante é para gases. Se o gás não estiver nas CNTP, pode se calcular através da seguinte fórmula para gases ideiais:

Onde:
n = número de mols
m = massa (g)
MM = massa molar (g/mol)
Ligações de Hidrogênio

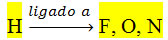
.jpg)
Química
Diferentemente do que muitos estudantes pensam, a Química é uma ciência que não está limitada somente às pesquisas de laboratório e à produção industrial. Pelo contrário, ela está muito presente em nosso cotidiano das mais variadas formas e é parte importante dele.
Seu principal foco de estudo é a matéria, suas transformações e a energia envolvida nesses processos. A Química explica diversos fenômenos da natureza e esse conhecimento pode ser utilizado em benefício do próprio ser humano.
Os avanços da tecnologia e da sociedade só foram possíveis graças às contribuições da Química. Por exemplo: na medicina, em que os medicamentos e métodos de tratamento têm prolongado a vida de muitas pessoas; no desenvolvimento da agricultura; na produção de combustíveis mais potentes e renováveis; entre outros aspectos extremamente importantes.
Ao mesmo tempo, se esse conhecimento não for bem usado, ele pode (assim como vimos acontecer algumas vezes ao longo da história) ser usado de forma errada. De tal modo, o futuro da humanidade depende de como será utilizado o conhecimento químico. Daí a importância do estudo desta ciência.
Química Analítica: como o próprio nome já retrata, esta área reserva-se à análise em laboratório. Existem dois tipos possíveis de análise, a qualitativa e a quantitativa. A primeira analisa as substâncias que se fazem presente em uma mistura, e a última determina a quantidade de tais substâncias em meio ao processo. Para o procedimento, são usados diversos instrumentos, como, por exemplo, soluções indicadoras de pH.
Bioquímica: ciência especializada em organismos vivos, ela aborda as reações químicas que acontecem no que se referem ao âmbito orgânico e molecular. Exemplo: o estudo envolve reações que ocorrem em seres vivos durante a digestão, metabolismo, respiração, etc. Tais organismos não podem ser vistos a olho nu, e por isso este tipo de análise é feita com a ajuda de microscópios.
Biotecnologia: ciência nova que se associa com a química para a criação de vegetais mais resistentes, animais geneticamente modificados, cura para doenças, etc. Consiste na aplicação da bioquímica para modificar material genético da flora e fauna.
Tanto a Bioquímica como a Biotecnologia são áreas que requerem também um conhecimento biológico para serem executadas.
Agora vamos falar das áreas mais tradicionais da Química, elas inclusive compõem os conteúdos disciplinares de Química, aplicados na esfera educacional.
Química Inorgânica: área da química destinada ao estudo de substâncias inorgânicas como minerais, sais, silicatos, etc. É uma ciência que aborda muitos compostos, com exceção daqueles que contêm carbono na composição.
Química Orgânica: agora sim, vamos tratar do estudo voltado para os compostos do carbono. A Orgânica trata especificamente das substâncias que contêm o elemento Carbono (C) na composição, e a cada dia, com as constantes descobertas, torna-se maior o número de membros desta classe.
Físico-química: envolve a compreensão das reações químicas, o estudo detalhado sobre como e por que elas ocorrem. Esta área é reservada para a análise das propriedades físicas e comportamentais das substâncias em meio ao processo.
___________________________________
Teorias Ácidos-Base
Ácidos e Bases de Brönsted-Lowry
Apresenta explicação do comportamento das espécies químicas até então aguardavam alguma definição pelas teorias existentes. Segundo os cientistas, J.N. Brönsted na Dinamarca e T.M. Lowry na Inglaterra, no ano de 1923 de maneira independente introduziram o conceito de ácido-base, enunciando em sua teoria que:
- Ácido é toda espécie química doadora de prótons H+.
- Base é toda espécie química receptora de prótons H+.
De acordo com essa definição, é evidente, que ambos coexistam na forma de par conjugado ácido-base, ou seja, obrigatoriamente a base recebe o próton doado pelo ácido, caso contrário não se aplica a teoria. É importante ainda salientar que algumas espécies podem comportar-se como ácido ou base sendo chamada de anfótero, esse comportamento é observado em função do tamanho minúsculo do íon que por estar no centro de um campo elétrico tem uma afinidade maior com moléculas, que não tem seus elétrons compartilhados. A equação genérica expressa de maneira conveniente o fundamento da teoria:
Esta equação mostra que a Base2 é uma receptora de prótons doados pelo Ácido1, confirmando assim a existência de um para conjugado, esta também pode ser considerada uma equação de neutralização ou protólise dos ácidos e bases. Em virtude de esta definição ser adaptável a diversos tipos de reação, não é necessário postulados como hidrolise, neutralização e dissociação, por simplesmente, a doação e recepção de um próton ser adaptáveis para as reações em geral. Para melhor entendimento segue-se as reações abaixo:

O cloreto de hidrogênio, não é condutor de corrente elétrica, portanto é um composto covalente, em razão de sua reação com água observa-se a formação de íons exatamente como a reação acima mostra. Simplificando, o HCl funciona como um ácido doando seu próton para água que comporta-se como base recebendo o mesmo, e liberando Cl- que é a base conjugada do HCl e água por sua vez recebe o próton formando o H3O+.
Concluindo uma reação de protólise ou neutralização é simplesmente a ligação entre H+ e OH-, formando água, isto representa um método seguro para equilibrar equações de neutralização.
Ácidos e Bases de Lewis
Esta teoria foi criada pelo químico americano Gilbert Newton Lewis (1875-1946) e diz o seguinte:

Essa teoria introduz um conceito novo, é mais abrangente, mas não invalida a teoria de Brönsted-Lowry. Pois todo ácido de Lewis é um ácido de Brönsted, e consequentemente toda base de Lewis é uma base de Brönsted. Isto ocorre porque um próton recebe elétrons, ou seja, um ácido de Lewis pode unir-se a um par solitário de elétrons em uma base de Lewis.
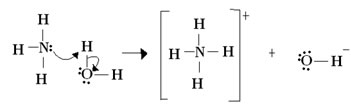
Para Lewis, uma reação ácido-base consiste na formação de uma ligação covalente coordenada mais estável. Assim, quando uma base de Lewis doa um par de elétrons para uma base de Lewis, ambos formam uma ligação covalente coordenada, em que ambos os elétrons provém de um dos átomos, como ocorre no exemplo abaixo:

Nesse caso, a amônia atua como a base de Lewis e de Brönsted, pois ela doa os seus dois elétrons para o próton, sendo, portanto, a receptora do próton. Além disso, formou-se uma ligação covalente entre o hidrogênio (o próton) e a amônia.
Já a água é o ácido de Lewis e de Brönsted, pois ele doa o próton e recebe os elétrons, note como o oxigênio do hidróxido formado a partir da água ficou com um par de elétrons a mais.
Ácidos e Bases de Arrhenius
Para este cientista, os ácidos e as bases são eletrólitos, que em contato com a água liberam íons.
Quando um ácido libera íons em solução aquosa, acontece uma ionização.
Exemplo:
HCl + H2OH+ + Cl-
Na realidade, libera o íon hidrônio (h2O+) assim:
HCl + H2Oh2O+ + Cl-
Quando uma base libera íons em solução aquosa, acontece uma dissociação.
Exemplo:
NaOH + H2ONa+ + OH-
Ácido de Arrhenius – é toda substância que em água produz um cátion H+.
Base de Arrhenius – é toda a substância que em água produz um ânion OH-.
Quadro-resumo das teorias ácido-base:
| TEORIA | ÁCIDO | BASE |
| ARRHENIUS | Libera H+ em solução aquosa | Libera OH- em solução aquosa |
| BRONSTED-LOWRY | Doa 1 próton | Recebe 1 próton |
| LEWIS | Recebe par de elétrons | Doa par de elétrons |
Fonte: soq.com.br
TABELA PERIÓDICA
A partir do século XIX, cientistas começaram a perceber que os elementos químicos poderiam ser agrupados em colunas, formadas pela reunião de elementos com propriedades semelhantes.
O número de elementos químicos conhecidos pelo homem aumentou com o passar dos séculos, principalmente no XIX.
Depois de tantos químicos tentarem classificar os elementos químicos, Dimitri Ivanovitch Mendeleyevfoi o que mais se destacou. Seu trabalho em classificar os elementos é usado até hoje. Ele criou uma tabela periódica dos elementos, que serviu de base para organizar a que temos hoje.
Mendeleyev observou que há uma periodicidade das propriedades quando os elementos químicos eram colocados em ordem crescente de suas massas atômicas.
Lei da periodicidade – muitas propriedades físicas e químicas dos elementos variam periodicamente na sequência de seus números atômicos.
Cada quadro da tabela fornece os dados referentes ao elemento químico: símbolo, massa atômica, número atômico, nome do elemento, elétrons nas camadas e se o elemento é radioativo.
As filas horizontais são denominadas períodos. Neles os elementos químicos estão dispostos na ordem crescente de seus números atômicos. O número da ordem do período indica o número de níveis energéticos ou camadas eletrônicas do elemento.
1º período – 2 elementos
2º período – 8 elementos
3º período – 8 elementos
4º período – 18 elementos
5º período – 18 elementos
6º período – 32 elementos
7º período – até agora 30 elementos
2º período – 8 elementos
3º período – 8 elementos
4º período – 18 elementos
5º período – 18 elementos
6º período – 32 elementos
7º período – até agora 30 elementos
As colunas verticais constituem as famílias ou grupos, nas quais os elementos estão reunidos segundo suas propriedades químicas.
As famílias ou grupos vão de 1 a 18. Algumas famílias possuem nome, como por exemplo:
1 – alcalinos
2 – alcalinos terrosos
13 – família do boro
14 – família do carbono
15 – família do nitrogênio
16 – família dos calcogênios
17 – família dos halogênios
18 – gases nobres
1 – alcalinos
2 – alcalinos terrosos
13 – família do boro
14 – família do carbono
15 – família do nitrogênio
16 – família dos calcogênios
17 – família dos halogênios
18 – gases nobres
(Nota: Chamo a atenção a posição do Hidrogênio. Apesar de sua localização na tabela ele não pertence a família dos Metais Alcalinos (Família 1A).
Da família 1 e 2 e 13 até 18 chamamos de elementos representativos.
Da família do 3 até 12 chamamos de elementos de transição.
Os elementos que ficam na série dos lantanídeos e actinídeos são os elementos de transição.
Os elementos químicos estão reunidos em três grandes grupos: metais, não-metais e gases nobres. O hidrogênio (H) não se encaixa em nenhuma dessas classificações porque possui características próprias. Algumas tabelas mostram esta divisão.
 Os metais são elementos químicos que possuem várias propriedades específicas, como brilho, condutividade térmica e elétrica, maleabilidade e ductibilidade. Todos os metais são sólidos à temperatura de 25ºC e pressão de 1atm, exceto o mercúrio (Hg) que é líquido nestas condições.
Os metais são elementos químicos que possuem várias propriedades específicas, como brilho, condutividade térmica e elétrica, maleabilidade e ductibilidade. Todos os metais são sólidos à temperatura de 25ºC e pressão de 1atm, exceto o mercúrio (Hg) que é líquido nestas condições.
Nem sempre um metal puro apresenta as propriedades desejáveis para determinadas aplicações. Por isso são produzidas as ligas metálicas, onde dois ou mais metais são misturados. São exemplos o bronze e o latão. O bronze é uma mistura de cobre, estanho e o latão é resultado da mistura de cobre e zinco.
A maioria das ligas é formada por dois ou mais metais, mas algumas contêm não-metais, como o carbono. A liga mais usada desse tipo é o aço.

 Os semimetais, em determinadas condições comportam-se como metais, noutras como não-metais. Os semimetais apresentam brilho metálico, tem pouca condutibilidade térmica e fragmentam-se.
Os semimetais, em determinadas condições comportam-se como metais, noutras como não-metais. Os semimetais apresentam brilho metálico, tem pouca condutibilidade térmica e fragmentam-se.
Os não-metais são maus condutores de eletricidade, quase não apresentam brilho, não são maleáveis e nem dúcteis. Tendem a formar ânions (íons negativos).
Os gases nobres ou inertes, ou ainda raros, constituem cerca de 1% do ar. É muito difícil se conseguir compostos com estes gases. Raramente eles reagem porque são muito estáveis. Suas camadas exteriores estão completamente preenchidas de elétrons. Estão todos no grupo 18 da tabela periódica.
Na tabela periódica atual, existem elementos naturais e artificiais.
Os naturais são os elementos encontrados na natureza e os artificiais são produzidos em laboratórios.
Dois estão localizados antes do urânio (U-92), os chamados elementos cisurânicos, que são o tecnécio (Tc – 43) e o promécio (Pm – 61). Outros elementos artificiais vêm depois do urânio, chamamos detransurânicos que são todos os outros após o U – 92. Dentre eles: Pu, Am, Bk, Fm, No, Sg, Ds.
Dois estão localizados antes do urânio (U-92), os chamados elementos cisurânicos, que são o tecnécio (Tc – 43) e o promécio (Pm – 61). Outros elementos artificiais vêm depois do urânio, chamamos detransurânicos que são todos os outros após o U – 92. Dentre eles: Pu, Am, Bk, Fm, No, Sg, Ds.
PROPRIEDADES PERIÓDICAS E APERIÓDICAS
Muitas propriedades dos elementos químicos vaiam periodicamente ao longo da Tabela periódica. São as chamadas Propriedades Periódicas.
As propriedades periódicas podem ser: raio atômico, volume atômico, densidade absoluta, eletronegatividade, eletropositividade, eletroafinidade.
Esse fato obedece a Lei da Periodicidade de Moseley:
“Muitas propriedades físicas e químicas dos elementos variam periodicamente na sequência de seus números atômicos.”
Raio Atômico
 O raio atômico dos elementos é uma propriedade periódica porque seus valores só variam periodicamente, ou seja, aumentam e diminuem seguidamente, com o aumento do número atômico.
O raio atômico dos elementos é uma propriedade periódica porque seus valores só variam periodicamente, ou seja, aumentam e diminuem seguidamente, com o aumento do número atômico.O raio atômico (r) é a metade da distância internuclear mínima (d) que dois átomos desse elemento podem apresentar, sem estarem ligados quimicamente.
Para medir o raio atômico, usa-se a técnica da difração por Raios-X.
Em uma família, da tabela periódica, o raio atômico aumenta de cima para baixo e no período aumenta da direita para esquerda.
Para esta regra não é admitido os gases nobres, já que possuem o maior raio atômico em cada período.
Observando a tabela periódica, podemos verificar que o frâncio (Fr) tem maior raio atômico.
Se o átomo se transforma em íon cátion ou ânion, o seu raio sofre alteração.
- o raio do átomo é sempre maior que o raio do seu íon cátion porque perde elétrons.
- o raio do átomo é sempre menor que o raio do seu íon ânion porque ganha elétrons.
Para esta regra não é admitido os gases nobres, já que possuem o maior raio atômico em cada período.
Observando a tabela periódica, podemos verificar que o frâncio (Fr) tem maior raio atômico.
Se o átomo se transforma em íon cátion ou ânion, o seu raio sofre alteração.
- o raio do átomo é sempre maior que o raio do seu íon cátion porque perde elétrons.
- o raio do átomo é sempre menor que o raio do seu íon ânion porque ganha elétrons.
Dicas de Química Sobre:
ESTEQUIOMETRIA
Antes de efetuar um cálculo estequiométrico é importante saber cacular a massa atômica das substâncias.
Cálculo da massa molecular (MM)
Sua unidade é em gramas (g).
Procura-se o valor da massa atômica do elemento químico na tabela períodica.
Procura-se o valor da massa atômica do elemento químico na tabela períodica.
Ex.
He = 4,00g
Ne = 20,18g
Se na substância tiver mais de um elemento ou do mesmo elemento, calcula-se somando as massas atômicas destes elementos. Se tiver do mesmo, multiplica-se.
Ex.
H2O = 16 + 2. (1) = 18g
C12H22O11 = 11. (16) + 22. (1) + 12. (12) = 342g
Ca(NO3)2 = 2.3.(16) + 2. (14) + 40 = 164g
MOL
O mol sempre indica:
- quantidade
- massa
- volume
- quantidade
- massa
- volume
A quantidade é um número muito grande que foi determinado experimentalmente, o Número de Avogadro (6,02.1023).
Assim como existe a dúzia, existe o Número de Avogadro.
Se a dúzia indica 12 unidades de qualquer coisa, o Número de Avogadro indica 6,02.1023 unidades de qualquer coisa. Neste caso, é usado para quantificar átomos, moléculas, íons e tantas outras partículas subatômicas, muito pequenas.
Assim como existe a dúzia, existe o Número de Avogadro.
Se a dúzia indica 12 unidades de qualquer coisa, o Número de Avogadro indica 6,02.1023 unidades de qualquer coisa. Neste caso, é usado para quantificar átomos, moléculas, íons e tantas outras partículas subatômicas, muito pequenas.
O mol também indica massa. É a mesma massa que encontramos na Tabela Periódica, porém em gramas (g). portanto um mol de uma substância é igual à sua massa atômica.
O mol indica volume nas CNTP, que quer dizer condições normais de temperatura e pressão. A temperatura deve ser 0°C ou 273K e a pressão 1 atm. Se estas condições forem satisfeitas, um mol de um gás será 22,4L. (Essa parte é muito importante entender pois tem questões que colocam o "Q" da questão nessa parte. Parte simples.)
Esta constante é para gases. Se o gás não estiver nas CNTP, pode se calcular através da seguinte fórmula para gases ideiais:
P.V = n. R. T
Onde:
P = pressão (atm)
V = volume (L)
n = número de mols
R = constante de Clapeyron = 0,082 atm.L/mol.K
T = temperatura (K)
P = pressão (atm)
V = volume (L)
n = número de mols
R = constante de Clapeyron = 0,082 atm.L/mol.K
T = temperatura (K)
Estequiometria Comum ou da Fórmula
Estes cálculos são relações de grandezas. Utiliza-se regras de três simples.
Colocar sempre na primeira linha os dados que já sabemos e na segunda linha os dados que devem ser calculados.
Veja o exemplo:
- Quantas gramas de água há em 3 mol de água?
Se 1 mol há 18 gramas (calcular a massa molecular com a ajuda da tabela periódica) então 3 mol tem quantas gramas?
Na primeira linha, coloca-se os dados conhecidos, ou seja, que um mol tem 18 gramas:
Na segunda linha, coloca-se os dados que queremos calcular, ou seja, que 3 mols terá x gramas. Sempre colocando unidade embaixo da mesma unidade.
Na primeira linha, coloca-se os dados conhecidos, ou seja, que um mol tem 18 gramas:
Na segunda linha, coloca-se os dados que queremos calcular, ou seja, que 3 mols terá x gramas. Sempre colocando unidade embaixo da mesma unidade.
Assim temos:
1 mol – 18g
3 mol – x(g)
3 mol – x(g)
x = 54g de H2O
Estequiometria da Equação Química
Para estes cálculos, pode-se seguir alguns passos:
1. fazer o balanceamento da equação química (acertar os coeficientes estequiométricos);
2. fazer contagem de mol de cada substância;
3. ler no problema o que pede;
4. relacionar as grandezas;
5. calcular com regra de três (proporção).
2. fazer contagem de mol de cada substância;
3. ler no problema o que pede;
4. relacionar as grandezas;
5. calcular com regra de três (proporção).
É sempre importante relacionar as substâncias que tem dados e a substância que se deseja calcular alguma grandeza.
Cálculo de Pureza
Este cálculo é muito utilizado nos laboratórios químicos, já que nenhuma substância é 100% pura. Sempre há alguma impureza. Por este motivo, alguns problemas já indicam a quantidade de impureza ou o quanto a substância é pura.
Se uma amostra de 40g de NaCl é 70% pura, quanto de NaCl há na amostra?
40g – 100%
x (g) – 70%
x (g) – 70%
x = 28g de NaCl
Este é o primeiro passo para os cálculos estequiométricos que envolvem reações químicas com cálculo de pureza.
Cálculo de Rendimento
Nenhuma reação química tem 100% de aproveitamento. Geralmente a quantidade de produto pode ser inferior ao valor esperado. Neste caso, o rendimento não foi total. Isto pode acontecer por várias razões, como por exemplo, má qualidade dos aparelhos ou dos reagentes, falta de preparo do operador, etc.
O cálculo de rendimento é feito relacionando o valor esperado e o valor obtido de produto.
- Numa determinada reação química deve-se obter 500g. Porém, a reação só teve 60% de rendimento. Qual o valor da massa obtida de produto?
100 % – 500g
60% – x (g)
60% – x (g)
x = 300g
Constantes e conversões úteis:
Constante de Clapeyron:
R= 0,082atm.L/mol.K
R= 8,314/mol.K
R= 1,987cal/mol.K
R= 0,082atm.L/mol.K
R= 8,314/mol.K
R= 1,987cal/mol.K
Número de Avogadro: 6,02.1023
Pressão:
1atm = 760mmHg = 101325Pa
1Torr = 1mmHg
1atm = 760mmHg = 101325Pa
1Torr = 1mmHg
Volume:
1mL = 1cm³
1dm³ = 1L = 1000mL
1mL = 1cm³
1dm³ = 1L = 1000mL
Massa:
1000Kg = 1ton
1Kg = 1000g
1g = 1000mg
1000Kg = 1ton
1Kg = 1000g
1g = 1000mg
Comprimento:
1nm = 1.10-9m
1nm = 1.10-9m
Fórmula para cálculo do número de mols (n):
Onde:
n = número de mols
m = massa (g)
MM = massa molar (g/mol)
Fonte: http://soq.com.br/
Ligações de Hidrogênio
Você sabia que esta ligação intermolecular explica o fato do gelo flutuar na água??

As moléculas das substâncias nos três estados físicos (sólido, líquido e gasoso) se atraem por meio de uma das forças intermoleculares.
As três forças intermoleculares conhecidas são: dipolo induzido – dipolo induzido, dipolo permanente – dipolo permanente e ligação de hidrogênio. Entre elas, a ligação de hidrogênio é a mais forte.
Esse tipo de interação ocorre quando a molécula possui hidrogênio ligado a flúor, nitrogênio ou oxigênio, que são átomos fortemente eletronegativos.
Ou seja, um átomo muito eletropositivo (Hidrogênio) ligado a um átomo muito eletronegativo (Flúor, Oxigênio ou Nitrogênio).
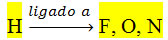
A ligação de hidrogênio é um exemplo extremo da ligação dipolo permanente-dipolo permanente. Pois o hidrogênio de uma molécula constitui um polo positivo, que se liga a um desses átomos de flúor, oxigênio ou nitrogênio de outra molécula, que constituem o polo negativo delas.
Normalmente, as ligações intermoleculares ocorrem com as substâncias nos estados líquido e sólido. Além disso, visto que é uma força de atração muito intensa, é necessária uma energia bem alta para rompê-la.
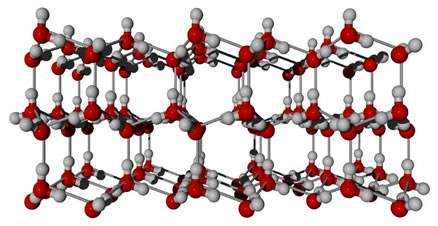
Uma substância que apresenta essa força intermolecular é a própria água. Observe como isso ocorre na ilustração abaixo:
.jpg)
Observe que cada molécula de água fica circundada espacialmente por outras quatro moléculas de água, sendo que as ligações de hidrogênio ocorrem pela ligação entre o hidrogênio de uma molécula (polo positivo) com o oxigênio de outra (polo negativo).
As ligações de hidrogênio explicam vários fenômenos da natureza, veja os seguintes exemplos:
- O fato de o gelo flutuar na água: O gelo é menos denso do que a água e, consequentemente, flutua nela. Isso ocorre porque enquanto no estado líquido as ligações de hidrogênio que ocorrem entre as moléculas de água estão dispostas numa forma desorganizada, as ligações de hidrogênio nas moléculas do gelo são mais espaçadas e organizadas, formando uma estrutura rígida de forma hexagonal, que faz as moléculas ocupar um espaço bem maior do que ocupariam se estivessem no estado líquido.

É inclusive por isso que se colocarmos água no volume total de uma garrafa e a colocarmos posteriormente em um refrigerador, seu volume se expandirá e a garrafa irá rachar.
Assim, haverá a mesma quantidade de moléculas por unidade de volume, o que diminui a densidade, segundo a fórmula da densidade: d = m/v. Haverá espaços vazios entre os hexágonos formados, diminuindo a densidade dessa substância.


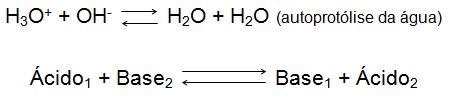


professor pq gelo seco queima hein?
ResponderExcluir